Pernahkah kamu membuat es batu atau minum es teh? Pada saat kamu membuat es batu berarti kamu telah mengubah wujud zat yaitu dari cair (air) menjadi padat (es). Demikian juga sebaliknya, es batu dalam es teh lama-kelamaan akan mencair. Pada kedua peristiwa tersebut telah terjadi perubahan fisika. Apakah perubahan fisika itu dan bagaimana sifat-sifat dari wujud zat itu? Jawaban dari pertanyaan-pertanyaan di atas dapat kamu temukan setelah kamu mempelajari bab berikut. Pada bab IV ini kamu akan belajar memahami berbagai sifat dalam perubahan fisika dan kimia. Diharapkan kamu mengerti sifat fisika dan sifat kimia zat, dapat melakukan pemisahan campuran serta mengerti perubahan fisika dan perubahan kimia (reaksi kimia).
Kamu tentu tahu paku yang terbuat dari besi, atau bahkan pernah menggunakannya. Besi merupakan logam yang pada suhu kamar berwujud padatan. Jika tidak disimpan dengan baik, paku besi itu mudah berkarat. Bagaimana besi dapat berkarat? Bagaimana sifat-sifat fisika besi sebagai zat padat? Untuk mengetahuinya, marilah kita pelajari lebih lanjut agar jelas.
Coba perhatikan kursi yang kamu duduki, air yang kamu minum, dan udara yang kamu hirup! Apakah wujud zat-zat tersebut? Kursi berupa zat padat, air minum berupa zat cair, dan udara yang kamu hirup setiap saat berupa zat gas. Wujud zat tergolong sifat fisika. Tahukah kamu bahwa paku yang kamu diamkan di udara terbuka lama kelamaan akan berkarat? Perkaratan menunjukkan sifat kimia.
Sifat fisika merupakan sifat materi yang dapat dilihat secara langsung dengan indra. Sifat fisika antara lain wujud zat, warna, bau, titik leleh, titik didih, massa jenis, kekerasan, kelarutan, kekeruhan, dan kekentalan. Kamu akan mempelajari beberapa sifat fisika tersebut.
a. Wujud zat
Wujud zat dibedakan atas zat padat, cair, dan gas. Kamu telah mempelajari sifat-sifat zat padat, cair, dan gas pada Bab III. Untuk mengingat kembali, coba perhatikan sifat-sifat dari ketiga wujud zat tersebut ada berikut:
Padatan memiliki bentuk tetap karena partikel-partikelnya diikat erat bersama, sering dalam pola teratur yang disebut dengan kisi (lattice). Dalam suatu cairan, gaya antarpartikel terlalu lemah untuk menahannya dalam formasi yang tetap sehingga partikel-partikel ini dapat bergeser dengan mudah dan saling melewati satu sama lain. Energi kinetik partikelpartikel gas cukup besar. Gas juga memiliki energi kinetic yang cukup untuk menyebar dan memenuhi seluruh tempat atau wadahnya. Perhatikan susunan partikel-partikel zat padat, cair dan gas pada gambar berikut.
b. Kekeruhan (Turbidity)
Kekeruhan terjadi pada zat cair. Kekeruhan cairan disebabkan adanya partikel suspensi yang halus. Jika sinar cahaya dilewatkan pada sampel keruh maka intensitasnya akan berkurang karena dihamburkan. Hal ini bergantung konsentrasinya. Alat untuk mengetahui intensitas cahaya pada zat cair yang keruh ini atau untuk mengetahui tingkat kekeruhan disebut turbidimetry.
c. Kekentalan (Viskositas)
Kekentalan atau viskositas adalah ukuran ketahanan zat cair untuk mengalir. Untuk mengetahui kekuatan mengalir (flow rate) zat cair digunakan viskometer. Flow rate digunakan untuk menghitung indeks iskositas. Aliran atau viskositas suau cairan dibanding dengan aliran air memberikan viskositas relatif untuk cairan tersebut. Angka pengukuran viskositas relatif cairan disebut dengan indeks viskositas. Indeks viskositas dapat dirumuskan seperti berikut.

Angka indeks viskositas suatu cairan di bawah 1 berarti viskositasnya di bawah viskositas air. Adapun angka indeks viskositas di atas 1 berarti viskositasnya di atas viskositas air. Viskositas cairan terjadi arena gesekan antara molekulmolekul. Viskositas sangat dipengaruhi oleh struktur molekul cairan. Jika struktur molekulnya kecil dan sederhana maka molekul tersebut dapat bergerak cepat, misalkan air. Jika molekulnya besar dan saling bertautan maka zat tersebut akan bergerak sangat lambat, misalkan oli. Molekul-molekul cairan yang bergerak cepat dikatakan memiliki viskositas atau kekentalan rendah sedangkan molekul cairan yang bergerak lambat dikatakan memiliki kekentalan tinggi.
d. Titik Didih
Titik didih merupakan suhu ketika suatu zat mendidih. Mendidih berbeda dengan menguap. Mendidih terjadi pada suhu tertentu, yaitu pada titik didih sedangkan menguap terjadi pada suhu berapa saja di awah titik didih. Misal pada saat kamu menjemur pakaian, maka airnya menguap bukan mendidih. Titik didih berbagai zat berbeda, bergantung pada struktur dan sifat bahan. Perhatikan titik didih beberapa zat pada tekanan 1 atm pada berikut.
Titik didih berbagai zat pada tekanan 1 atm.
A. Sifat Fisika dan Sifat Kimia
Coba perhatikan kursi yang kamu duduki, air yang kamu minum, dan udara yang kamu hirup! Apakah wujud zat-zat tersebut? Kursi berupa zat padat, air minum berupa zat cair, dan udara yang kamu hirup setiap saat berupa zat gas. Wujud zat tergolong sifat fisika. Tahukah kamu bahwa paku yang kamu diamkan di udara terbuka lama kelamaan akan berkarat? Perkaratan menunjukkan sifat kimia.
1. Sifat Fisika
Sifat fisika merupakan sifat materi yang dapat dilihat secara langsung dengan indra. Sifat fisika antara lain wujud zat, warna, bau, titik leleh, titik didih, massa jenis, kekerasan, kelarutan, kekeruhan, dan kekentalan. Kamu akan mempelajari beberapa sifat fisika tersebut.
a. Wujud zat
Wujud zat dibedakan atas zat padat, cair, dan gas. Kamu telah mempelajari sifat-sifat zat padat, cair, dan gas pada Bab III. Untuk mengingat kembali, coba perhatikan sifat-sifat dari ketiga wujud zat tersebut ada berikut:
No | Zat Padat | Zat Cair | Zat Gas |
1. | Mempunyai bentuk dan volume tertentu. | Bentuk tidak tetap bergantung wadahnya, volume tertentu. | Tidak mempunyai bentuk dan volume tertentu, bergantung tempatnya. |
2. | Jarak antarpartikel sangat rapat | Jarak antarpartikel agak renggang. | Jarak antarpartikel sangat renggang. |
3. | Partikel-partikelnya tidak dapat bergerak bebas | Partikel-partikelnya dapat bergerak bebas. | Partikel-partikelnya dapat bergerak sangat cepat. |
Padatan memiliki bentuk tetap karena partikel-partikelnya diikat erat bersama, sering dalam pola teratur yang disebut dengan kisi (lattice). Dalam suatu cairan, gaya antarpartikel terlalu lemah untuk menahannya dalam formasi yang tetap sehingga partikel-partikel ini dapat bergeser dengan mudah dan saling melewati satu sama lain. Energi kinetik partikelpartikel gas cukup besar. Gas juga memiliki energi kinetic yang cukup untuk menyebar dan memenuhi seluruh tempat atau wadahnya. Perhatikan susunan partikel-partikel zat padat, cair dan gas pada gambar berikut.
 |
| (a) Susunan partikel zat padat, (b) zat cair, dan (c) zat gas. |
Kekeruhan terjadi pada zat cair. Kekeruhan cairan disebabkan adanya partikel suspensi yang halus. Jika sinar cahaya dilewatkan pada sampel keruh maka intensitasnya akan berkurang karena dihamburkan. Hal ini bergantung konsentrasinya. Alat untuk mengetahui intensitas cahaya pada zat cair yang keruh ini atau untuk mengetahui tingkat kekeruhan disebut turbidimetry.
c. Kekentalan (Viskositas)
Kekentalan atau viskositas adalah ukuran ketahanan zat cair untuk mengalir. Untuk mengetahui kekuatan mengalir (flow rate) zat cair digunakan viskometer. Flow rate digunakan untuk menghitung indeks iskositas. Aliran atau viskositas suau cairan dibanding dengan aliran air memberikan viskositas relatif untuk cairan tersebut. Angka pengukuran viskositas relatif cairan disebut dengan indeks viskositas. Indeks viskositas dapat dirumuskan seperti berikut.

Angka indeks viskositas suatu cairan di bawah 1 berarti viskositasnya di bawah viskositas air. Adapun angka indeks viskositas di atas 1 berarti viskositasnya di atas viskositas air. Viskositas cairan terjadi arena gesekan antara molekulmolekul. Viskositas sangat dipengaruhi oleh struktur molekul cairan. Jika struktur molekulnya kecil dan sederhana maka molekul tersebut dapat bergerak cepat, misalkan air. Jika molekulnya besar dan saling bertautan maka zat tersebut akan bergerak sangat lambat, misalkan oli. Molekul-molekul cairan yang bergerak cepat dikatakan memiliki viskositas atau kekentalan rendah sedangkan molekul cairan yang bergerak lambat dikatakan memiliki kekentalan tinggi.
d. Titik Didih
Titik didih merupakan suhu ketika suatu zat mendidih. Mendidih berbeda dengan menguap. Mendidih terjadi pada suhu tertentu, yaitu pada titik didih sedangkan menguap terjadi pada suhu berapa saja di awah titik didih. Misal pada saat kamu menjemur pakaian, maka airnya menguap bukan mendidih. Titik didih berbagai zat berbeda, bergantung pada struktur dan sifat bahan. Perhatikan titik didih beberapa zat pada tekanan 1 atm pada berikut.
Titik didih berbagai zat pada tekanan 1 atm.
No | Nama Zat | Titik Didih (°C) |
1. 2. 3. 4. 5. | Nitrogen Oksigen Alkohol (etanol) Air Tembaga | -196 -183 78 100 2595 |
e. Titik Leleh
Titik leleh merupakan suhu ketika zat padat berubah menjadi zat cair. Misal garam dapur jika dipanaskan akan meleleh menjadi cairan. Perubahan ini dipengaruhi oleh struktur kristal zat padat tersebut. Zat cair dan zat gas juga memiliki titik leleh tetapi perubahannya tidak dapat diamati pada suhu kamar. Perhatikan titik leleh beberapa zat pada berikut.
Titik leleh berbagai zat pada tekanan 1 atm.
No | Nama Zat | Titik Didih (°C) |
1. 2. 3. 4. 5. 6. | Nitrogen Oksigen Alkohol (etanol) Air Tembaga Besi | -210 -216 -117 0 1083 1535 |
f. Kelarutan
Tahukah kamu contoh larutan? Contoh larutan gula, dan larutan garam. Larutan merupakan campuran homogen. Dalam larutan terdapat dua komponen yaitu pelarut dan terlarut. Pelarut merupakan zat yang melarutkan dan biasanya jumlahnya lebih banyak, sedangkan terlarut merupakan zat yang terlarut, biasanya jumlahnya lebih kecil. Misal larutan garam, maka zat terlarutnya garam dan pelarutnya air. Pada umumnya larutan berupa cairan tetapi larutan juga terjadi dalam bentuk gas dan padat. Contoh larutan gas adalah udara yang terdiri dari oksigen, nitrogen, karbon dioksida dan gas-gas lain. Contoh larutan padatan adalah stainless steel. Kelarutan menerangkan tingkat suatu zat saling melarutkan. Ahli kimia menerangkan kelarutan dengan istilah berupa banyaknya zat terlarut tertentu yang akan melarut ke dalam larutan tertentu pada suhu tertentu. Kemampuan melarut bergantung pada gaya tarik partikel zat terlarut dengan partikel pelarutnya. Misal dalam proses pelarutan garam dalam air, maka molekul air pertama-tama menarik molekul garam menjauh satu dengan lain hingga suatu saat tercapai suatu keadaan molekul air tidak mampu memisahkan molekul garam dari yang lain atau disebut jenuh. Perhatikan gambar berikut.
 |
| a. Molekul-molekul air (H2O), ion Na+ dan ion Cl¯. b. Molekul-molekul air menarik ion-ion dari kristal. c. Molekul-molekul air mengelilingi ion-ion dalam larutan. |
a. Molekul-molekul air (H2O), ion Na+ dan ion Cl¯.
b. Molekul-molekul air menarik ion-ion dari kristal.
c. Molekul-molekul air mengelilingi ion-ion dalam larutan.
Butiran garam terdiri atas ion natrium dan klorida yang terikat bersama dalam formasi yang disebut kisi kristal. Air melarutkan garam dengan menarik ion dari kisi kristal dan mengelilinginya. Kelarutan dipengaruhi oleh beberapa faktor, antara lain seperti berikut.
1) suhu
2) volume pelarut
3) ukuran zat terlarut
4) jenis zat terlarut
5) jenis pelarut
Pada pokok bahasan ini, hanya akan dibahas pengaruh suhu, volume pelarut dan ukuran zat terhadap kelarutan suatu zat.
1) Suhu
Perhatikan saat kamu membuat air kopi. Gula dan kopi akan lebih cepat larut dalam air panas daripada dalam air dingin. Mengapa demikian? Pada saat melarutkan bentuk padat menjadi cair melibatkan penghancuran struktur yang kaku, atau kisi-kisi kistal dari zat padat. Pada peristiwa ini diperlukan energi. Kenaikan suhu menyebabkan energi kinetik partikel zat bertambah sehingga partikel pada suhu yang tinggi bergerak lebih cepat dibandingkan pada suhu rendah. Kondisi ini menyebabkan terjadinya tumbukan antara partikel zat terlarut dengan partikel pelarut.
2) Volume pelarut
Misalkan kamu melarutkan 2 sendok makan gula dalam 100 mL air dan melarutkan 2 sendok makan gula dalam 5.000 mL air, manakah yang lebih cepat larut? Gula 2 sendok makan akan lebih cepat larut dalam 5.000 mL air daripada dalam 100 mL air. Semakin besar volume pelarut, maka jumlah partikel pelarut akan semakin banyak. Kondisi tersebut memungkinkan lebih banyak terjadi tumbukan antara partikel zat terlarut dengan partikel zat pelarut sehingga zat padat umumnya lebih mudah larut.
3) Ukuran zat terlarut
Misalkan kamu melarutkan 2 sendok makan gula pasir halus dalam 100 mL air dan 1 sendok makan gula batu dalam 100 mL air, manakah yang lebih cepat larut? Gula pasir lebih cepat larut daripada gula batu. Hal ini karena gula pasir halus memiliki ukuran partikel yang lebih kecil sehingga memiliki permukaan sentuh yang luas dibandingkan gula batu. Jadi makin kecil ukuran zat terlarut makin besar kelarutan zat tersebut.
2. Sifat Kimia
Sifat kimia merupakan sifat yang dihasilkan dari perubahan kimia, antara lain mudah terbakar, mudah busuk, dan korosif. Sifat-sifat ini karakteristik.a. Mudah terbakar
Pernahkah kamu menyalakan kembang api? Saat kamu membakar kembang api maka dengan segera akan terjadi nyala warna-warni yang indah. Pada peristiwa ini terjadi perubahan kimia. Pada mulanya kembang api dibuat dari campuran antara kalium nitrat (KNO3) , belerang dan arang kayu. Namun sekarang kembang api telah dibuat dengan warna-warni, yaitu dari strontium dan litium (warna merah), natrium (warna kuning), barium (warna hijau), dan tembaga (warna biru). Contoh lain yang mudah terbakar adalah fosfor. Fosfor dapat terbakar bila kena udara, membentuk senyawa fosfor oksida. Oleh karena itu fosfor disimpan di dalam air. Fosfor dimanfaatkan untuk membuat korek api.
b. Mudah busuk
Jika buah dan sayur dibiarkan di udara terbuka maka lama kelamaan buah dan sayur tersebut akan membusuk. Buah dan sayur yang busuk akan menimbulkan bau yang tidak sedap. Proses pembusukan ini karena adanya mikroorganisme.
c. Korosif
Perkaratan atau korosi merupakan peristiwa rusaknya logam oleh pengaruh lingkungan, yaitu adanya oksigen dan kelembapan. Besi adalah salah satu contoh logam yang mudah berkarat. Pada proses korosi terbentuk zat yang jenisnya baru yaitu karat. Gejala yang tampak pada korosi adalah terjadi perubahan warna. Pada umumnya logam bersifat korosif kecuali emas, platina, dan air raksa.
B.Metode-Metode Pemisahan Campuran
 |
| Platina adalah logam yang langka. Untuk mendapatkan 50 gram platina membutuhkan 50 ton bebatuan yang mengandung platina, dipisahkan melalui proses kimia dan fisika. |
1. Penyaringan (Filtrasi)
Tahukah kamu apa filtrasi itu? Filtrasi atau penyaringan adalah teknik penyaringan yang dapat digunakan untuk memisahkan campuran yang ukuran partikel zat-zat penyusunnya berbeda. Misalnya, pada pembuatan santan kelapa. Santan kelapa dibuat dengan cara memisahkan campuran santan, air, dan
ampas kelapa dengan menggunakan saringan. Dengan menggunakan saringan yang berpori-pori kecil, santan kelapa dapat melewati lubang saringan dan ampas kelapa tertahan dalam saringan. Pernahkah kamu membuat air teh? Untuk mendapatkan air teh maka kamu perlu merendam teh dalam air panas, kemudian gunakan saringan untuk memisahkan teh dengan air tehnya. Nah, agar kamu lebih memahami proses pemisahan dengan cara filtrasi, lakukanlah kegiatan berikut.
Dari kegiatan kamu dapat mengamati butiran-butiran kapur tertahan pada kertas saring (residu). Adapun air dapat melewatinya (filtrat). Kertas saring memiliki pori-pori yang sangat kecil sehingga dapat menahan butiran-butiran kapur tersebut. Dasar dari penyaringan di atas adalah perbedaan ukuran partikel air dengan butiran kapur. Prinsip penyaringan banyak dimanfaatkan dalam kehidupan sehari-hari. Misalnya, kamu menggunakan saringan teh agar ampas teh tidak terbawa dalam air teh. Nah, dapatkah kamu menyebutkan contoh penyaringan lainnya dalam kehidupan seharihari? Diskusikanlah dengan teman sekelompokmu, kemudian bacakan hasilnya di depan kelas.
2. Sentrifugasi
 |
| (a) Darah sebelum disentrifugasi, (b) darah setelah sentrifugasi. (c) Komponen penyusun darah terpisah setelah disentrifugasi. |
3. Evaporasi (Penguapan)
Pada awal bab telah dijelaskan bahwa garam dapat diperoleh dari air laut dengan proses penguapan atau evaporasi. Nah, agar kamu lebih memahami pemisahan campuran dengan proses penguapan lakukanlah kegiatan berikut.
Pada proses penguapan, larutan dipanaskan sampai zat pelarutnya (air) menguap dan meninggalkan zat terlarut (garam). Proses pemisahan dengan cara penguapan ini dapat terjadi karena zat terlarut (garam) memiliki titik didih yang lebih tinggi daripada zat pelarutnya (air). Nah, dapatkah kamu memberikan contoh lainnya proses pemisahan campuran dengan penguapan? Diskusikanlah dengan temanmu, kemudian bacakan hasilnya di depan kelas.
4. Distilasi (Penyulingan)
Apakah yang disebut dengan distilasi? Distilasi atau penyulingan adalah proses pemisahan campuran dengan penguapan yang diikuti pengembunan. Mula-mula campuran yang akan dipisahkan dipanaskan hingga di atas titik didih zat yang akan dipisahkan. Oleh karena zat yang akan dipisahkan memiliki titik didih yang lebih rendah daripada larutan, maka zat tersebut akan menguap terlebih dahulu. Uap yang terbentuk kemudian didinginkan sehingga menjadi cairan. Cairan yang dihasilkan selanjutnya ditampung dalam suatu wadah sebagai distilat.
Apakah manfaat prinsip penyulingan dalam kehidupan sehari-hari? Prinsip penyulingan digunakan di industri minyak untuk memisahkan bensin, minyak tanah, dan solar dari minyak mentah. Hal ini dapat dilakukan karena komponen-komponen minyak bumi mempunyai titik didih yang berbeda-beda. Oleh karena dalam campuran (minyak mentah) terdapat lebih dari satu komponen yang akan dipisahkan maka harus dilakukan distilasi bertingkat atau biasa disebut distilasi fraksionasi.
5. Sublimasi
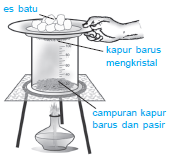 |
| Proses pemisahan kapur barus dari pasir dengan cara sublimasi. |
C. Proses Pengolahan Air
Tahukah kamu, berapa banyak air yang kamu buang dalam sehari? Tentu tak terhitung jumlahnya, bukan? Padahal, saat ini krisis air bersih mulai melanda negara kita. Hal ini disebabkan penjarahan hutan secara besar-besaran sehingga menyebabkan turunnya debit air bersih yang mengalir ke sungai. Dalam kondisi seperti itu, pencemaran air semakin hebat yang diakibatkan limbah rumah tangga dan industri. Jika kamu mengamati sungai-sungai di sekelilingmu, hanya sedikit sungai yang masih mengalirkan air bersih. Umumnya sungai mengalirkan air kotor berwarna kecokelatan. Beban lingkungan yang semakin berat akibat pencemaran air dan udara membuat kualitas air semakin buruk. Namun, di sisi lain, kebutuhan masyarakat akan air semakin meningkat akibat peningkatan jumlah penduduk. Fenomena tersebut tentunya memerlukan konsep pengelolaan sumber daya air yang terpadu dengan mempertimbangkan keseimbangan air. Air pada dasarnya merupakan sumber daya alam yang dapat diperbaharui dan merupakan sumber daya yang sangat penting dalam kehidupan makhluk hidup di dunia ini. Air minum harus memenuhi persyaratan-persyaratan dari segi fisik, kimia, maupun biologi.- Kualitas dari segi fisik yaitu tidak berwarna, tidak berbau, jernih, dan tidak berasa.
- Kualitas dari segi kimia yaitu air tidak mengandung zat-zat kimia yang beracun dan bebas dari garam-garam mineral.
- Kualitas dari segi biologi yaitu air harus terbebas dari organisme hidup penyebab penyakit.
 |
| Proses pengolahan air untuk menghasilkan air bersih. |
Dari Kegiatan kamu dapat mengamati bahwa dengan proses penyaringan akan diperoleh air bersih. Banyak zat yang menyebabkan air menjadi tidak jernih atau keruh. Oleh karena itu perlu dilakukan penjernihan air, karena kejernihan termasuk salah satu standar kualitas fisik air minum. Berikut ini cara sederhana untuk menjernihkan air.
- Pengendapan
Pengendapan dapat dilakukan dengan mengendapkan air dalam bak penampungan yang bersih dan bila kotor dikuras.
- Penyaringan/filtrasi
Air yang terlalu keruh karena adanya partikel tertentu tidak dapat dijernihkan hanya dengan pengendapan, tetapi perlu penyaringan. Penyaringan dilakukan secara bertahap dengan melalui saringan pasir halus, pasir kasar, dan batu gamping. Air mula-mula dilewatkan dalam pasir halus kemudian dilewatkan pasir kasar dan selanjutnya dalam batu gamping, sehingga akan didapatkan air yang lebih jernih dan bersih.
- Koagulasi
Terkadang ditemukan air masih keruh meskipun sudah dilakukan pengendapan dan penyaringan. Hal ini karena ukuran partikel penyebab keruh sangat kecil atau seukuran partikel koloid sehingga tidak dapat mengendap. Untuk mengendapkan partikel ini maka ditambahkan zat kimia yang berfungsi sebagai pengendap atau koagulan misalnya tawas atau aluminium sulfat (Al2(SO4)3 ⋅ 18 H2O)
D. Perubahan Materi
Perubahan materi merupakan kajian yang cukup penting di dalam ilmu kimia. Perubahan dapat diketahui dari perbedaan keadaan awal dan keadaan akhir materi setelah mengalami perubahan. Keadaan yang dimaksud meliputi sifat-sifat maupun strukturnya. Materi dapat dikenali berdasarkan sifat-sifat fisika maupun sifat-sifat kimianya. Yang termasuk sifat-sifat fisika antara lain wujud, warna, titik leleh, titik didih, dan kelarutan. Sifat-sifat kimia materi didasarkan pada kemampuannya dalam melakukan perubahan atau reaksi kimia. Misalnya, bensin lebih mudah terbakar daripada minyak tanah. Sehubungan dengan hal tersebut terdapat dua jenis perubahan materi, yaitu perubahan fisika dan perubahan kimia. Hal yang perlu digarisbawahi adalah perubahan fisika dapat menghasilkan perubahan wujud materi, tetapi tidak menghasilkan materi baru. Adapun perubahan kimia, menghasilkan materi baru. Nah, agar kamu lebih memahami perubahan fisika dan perubahan kimia pelajarila uraian berikut dengan baik.
1. Pengertian Perubahan Materi
Pada kehidupan sehari-hari kamu selalu melihat peristiwa perubahan materi, baik secara alami maupun dengan disengaja. Peristiwa perubahan materi secara alami, misalnya peristiwa pembusukan makanan atau perkaratan besi. Peristiwa perubahan materi dengan disengaja, misalnya kertas yang dibakar atau lilin yang dibakar. Nah, dari contoh-contoh perubahan materi di atas, manakah yang termasuk perubahan fisika dan yang termasuk perubahan kimia? Agar kamu lebih memahaminya lakukan Kegiatan berikut:
Dari Kegiatan diatas kamu dapat mengamati bahwa es yang awalnya berwujud padat, setelah dipanaskan akan berubah wujud menjadi air. Meskipun es mengalami perubahan wujud dari padat ke cair, tetapi es dan air masih memiliki sifat-sifat yang sama. Hal ini terbukti dengan rasa es batu sebelum dipanaskan sama dengan setelah dipanaskan. Perubahan materi yang tidak menghasilkan zat baru dinamakan perubahan fisika. Berbeda halnya dengan kertas yang dibakar, kertas tersebut mengalami perubahan materi yang menghasilkan zat yang baru, yaitu abu, asap, dan gas. Perubahan materi yang menghasilkan zat baru dinamakan perubahan kimia. Nah, agar kamu lebih memahami perbedaan antara perubahan fisika dan perubahan kimia, pelajarilah uraian
berikut dengan baik.
 |
| Pada proses peleburan besi, besi mengalami perubahan fisika akibat pemanasan |
- Perubahan Fisika
Kamu telah mengetahui bahwa es yang mencair tidak menghasilkan zat yang baru. Es dan air tersusun atas senyawa yang sama, yaitu H2O. Perbedaan antara es dan air hanya terlihat dari wujudnya saja. Es merupakan air yang berwujud zat padat, sedangkan air berwujud zat cair. Dapatkah kamu menyebutkan contoh perubahan fisika lainnya? Pada Gambar 4.10 kamu dapat mengamati proses peleburan besi. Batang besi yang dipanaskan dengan suhu tinggi akan berubah menjadi besi cair. Cairan besi yang sudah meleleh itu dimasukkan dalam cetakan. Setelah itu, dibiarkan menjadi dingin hingga terbentuk padat kembali. Pada proses peleburan besi, antara besi sebelum dileburkan dengan besi yang sudah menjadi cair masih memiliki sifat yang sama atau hanya mengalami perubahan wujud saja. Perubahan materi pada besi yang dileburkan dapat dikatakan sebagai perubahan fisika. Pada perubahan fisika memungkinkan kita mendapatkan kembali materi semula.
- Perubahan Kimia

Kayu yang dibakar merupakan
contoh perubahan
kimia.
Ketika kamu membuat api unggun dengan membakar kayu kering, maka akan dihasilkan abu, asap, dan gas. Sama halnya seperti pada kertas yang dibakar, kayu dan abu merupakan dua jenis zat yang sama sekali berbeda. Zat-zat hasil pembakaran tersebut tidak dapat dikembalikan lagi menjadi kayu. Oleh karena kayu yang dibakar menghasilkan zat baru yang sifatnya berbeda dengan zat asalnya, kayu yang dibakar merupakan contoh peristiwa perubahan kimia. Jadi perubahan kimia adalah perubahan materi yang menghasilkan zat yang jenisnya baru. Perubahan kimia disebut juga reaksi kimia. Dalam kehidupan sehari-hari, banyak reaksi kimia yang terjadi secara alamiah atau yang dibuat manusia. Nah, dapatkah kamu menyebutkan contoh reaksi kimia yang terjadi secara alamiah? Contoh reaksi kimia yang terjadi secara alamiah adalah perkaratan, pembusukan, respirasi, metabolisme dalam sel, dan reaksi fotosintesis. Adapun reaksi kimia buatan misalnya pembakaran minyak dan reaksi-reaksi kimia di laboratorium atau pada proses industri. Semua reaksi kimia menghasilkan zat yang sifat dan jenisnya baru. Berlangsungnya reaksi kimia ditandai dengan beberapa hal, di antaranya terbentuknya gas, endapan, dan perubahan warna. Pada perubahan kimia, sangat sulit untuk mendapatkan kembali materi semula (bersifat irreversibel). Perbedaan antara perubahan fisika dan perubahan kimia ditunjukkan pada Tabel berikut ini.
Perubahan FisikaPerubahan Kimia• Tidak terbentuk zat yang jenisnya baru.• Reversibel.• Tidak terjadi reaksi kimia.• Terbentuk zat yang jenis-nya baru.• Irreversibel.• Terjadi reaksi kimia, ditandai dengan pembentukan gas, endapan, warna, dan perubahan energi.
Setelah kamu mengetahui perbedaan antara perubahan fisika dan perubahan kimia, pada subbab ini kamu akan mencari tahu mengenai contoh-contoh perubahan fisika dan perubahan kimia dalam kehidupan sehari-hari.
a. Peristiwa Perubahan Fisika dalam Kehidupan Sehari-hari
 |
| Es bila dibiarkan di tempat terbuka akan menjadi air, hal ini merupakan contoh perubahan fisika. |
- Peristiwa Perubahan Fisika karena Perubahan Wujud
Peristiwa perubahan fisika yang mengakibatkan perubahan wujud dapat terjadi karena pengaruh pemanasan. Materi yang telah mengalami perubahan fisika karena perubahanwujud dapat dikembalikan pada wujud semula. Contoh perubahan fisika karena per-ubahan wujud, antara lain:
a) Es yang berwujud padat jika dibiarkan di tempat terbuka akan berubah wujud menjadi air.
b) Air jika dipanaskan akan berubah wujud menjadi uap.
c) Embun terjadi karena uap air di udara melepaskan panas dan menjadi air.
d) Kapur barus jika dibiarkan di tempat terbuka akanmenyublim menjadi gas.
- Peristiwa Perubahan Fisika karena Perubahan Bentuk
Tukang kayu mengubah kayu menjadi kursi dan meja. Perubahan materi dari kayu menjadi kursi termasuk perubahan fisika. Hal ini karena kayu hanya mengalami perubahan bentuk saja, sedangkan sifatnya tidak berubah. Contoh lain adalah perubahan materi dari aluminium menjadi teko, sendok, dan panci. Hal ini termasuk perubahan fisika karena aluminium hanya mengalami perubahan bentuk saja, sedangkan sifatnya tidak berubah.
- Peristiwa Perubahan Fisika karena Perubahan Ukuran
Contoh: biji kopi digiling menjadi serbuk kopi dan batu dipecah-pecah. Sifat kopi tidak berubah, yang berubah hanya ukurannya. Demikian juga dengan batu yang dipecah-pecah.
- Peristiwa Perubahan Fisika karena Perubahan Volume
Contoh: raksa atau alkohol dalam termometer memuai jika menyentuh permukaan yang panas sehingga dapat digunakan sebagai pengukur suhu. Sifat raksa dan alkohol tidak berubah meskipun mengalami pemuaian.
- Peristiwa Perubahan Fisika karena Perubahan Bentuk Energi
Ingat bahwa energi tidak dapat dihilangkan dan juga tidak dapat diciptakan. Energi hanya dapat diubah dari bentuk satu ke bentuk lain. Contoh: lampu pijar menyala dan kipas angin berputar.
- Peristiwa Perubahan Fisika karena Pelarutan
Pernahkah kamu membuat es jeruk? Jika kamu membuat es jeruk, kamu terlebih dahulu memeras jeruk untuk mengambil sari jeruknya, kemudian melarutkan sari jeruk tersebut ke dalam air dingin. Nah, apakah rasa jeruk tersebut berubah setelah kamu campurkan dengan air dingin? Rasa jeruk setelah dicampurkan dengan air dingin tetap sama. Oleh karena sifat jeruk tidak berubah setelah dilarutkan dalam air, peristiwa ini tergolong perubahan fisika karena pelarutan. Contoh lain perubahan fisika karena pelarutan adalah ketika kamu membuat kopi. Rasa kopi setelah dilarutkan dalam air tetap sama atau tidak berubah.
Hal-hal apa saja yang dapat mengakibatkan perubahan kimia? Perubahan kimia dapat terjadi karena peristiwa pembakaran, perkaratan, dan pembusukan.
- Peristiwa Perubahan Kimia karena Pembakaran
Salah satu perubahan kimia yang sering kita saksikan dalam kehidupan sehari-hari adalah peristiwa pembakaran. Tahukah kamu apakah pembakaran itu? Pembakaran adalah reaksi kimia antara materi yang terbakar dengan oksigen. Oleh karena itu, reaksi pembakaran sering disebut reaksi oksidasi. Nah, dapatkah kamu menyebutkan contoh peristiwa perubahan kimia karena pembakaran? Peristiwa kebakaran hutan merupakan salah satu contoh perubahan kimia akibat pembakaran. Contoh lainnya adalah pembakaran kembang api. Reaksi pembakaran banyak digunakan sebagai sumber energi. Misalnya, pembakaran bensin di dalam mesin mobil dapat menghasilkan energi gerak sehingga mobil dapat bergerak. Peristiwa perubahan kimia karena pembakaran juga terjadi dalam tubuhmu. Bahan makanan yang telah kamu makan diproses dalam tubuh dengan cara pembakaran sehingga menghasilkan energi yang dapat dimanfaatkan untuk melakukan aktivitas sehari-hari. Proses pembakaran kimia dalam tubuh dapat dituliskan sebagai berikut.
Bahan makanan >>>> karbon dioksida +
+ oksigen >>>> air + energi
Mengapa pada proses pembakaran dapat timbul asap? Asap terjadi akibat pembakaran yang tidak sempurna. Pembakaran tidak sempurna terjadi karena oksigen yang tersedia untuk bereaksi tidak mencukupi sehingga sebagian karbon tidak terbakar. Pembakaran yang tidak sempurna dapat menghasilkan gas beracun, yaitu karbon monoksida (CO).
- Peristiwa Perubahan Kimia karena Perkaratan
Apakah yang dimaksud dengan peristiwa perkaratan itu?Perkaratan adalah reaksi kimia antara logam dengan udara (oksigen) dan air. Perkaratan merupakan peristiwa perubahan kimia karena menghasilkan zat yang baru. Paku yang terbuat dari besi jika bereaksi dengan udara dan air, maka besi (Fe) tersebut dapat berubah menjadi karat besi (Fe2O3 ⋅ nH2O). Sifat besi dan karat besi sangat berbeda. Besi mempunyai sifat yang kuat, sedangkan karat besi mempunyai sifat yang rapuh. Faktor-faktor yang mempercepat proses perkaratan antara lain:
a) adanya uap air (udara yang lembap),
b) adanya uap garam atau asam di udara,
c) permukaan logam yang tidak rata,
d) singgungan dengan logam lain.
Peristiwa perkaratan ini menimbulkan banyak kerugian karena benda-benda yang terbuat dari besi menjadi rapuh dan cepat rusak. Nah, bagaimana cara mencegah peristiwa perkaratan pada besi? Peristiwa perkaratan pada besi dapat dicegah dengan cara:
a) menghindarkan kontak langsung antara benda yang terbuat dari besi dengan oksigen atau air. Ini dapat dilakukan dengan cara mengecat, melumuri besi dengan oli, membalut besi dengan plastik, atau
melapisi besi dengan timah; b) memperhalus permukaan logam, misalnya diamplas;
c) mencegah logam agar tidak terkena uap garam atau asam;
d) menyimpan logam di tempat kering.
- Peristiwa Perubahan Kimia karena Pembusukan
Pernahkah kamu menyimpan buah-buahan, seperti apel di tempat yang terbuka hingga beberapa hari? Apakah yang terjadi dengan apel tersebut? Apel yang dibiarkan di tempat terbuka dalam waktu yang
lama akan busuk. Pembusukan adalah peristiwa perubahan kimia karena mikroorganisme. Pada apel yang membusuk, apel berubah menjadi bau, berlendir, dan mengeluarkan gas. Oleh karena sifat apel setelah membusuk berbeda dengan apel sebelum membusuk, maka peristiwa pembusukan apel dapat dikatakan sebagai perubahan kimia.
Perubahan fisika berperan penting dalam industri obatobatan atau farmasi, yaitu dalam proses ekstrasi zat-zat aktif yang terkandung dalam bahan alam. Zat-zat aktif ini berguna untuk bahan baku obat. Senyawa yang terkandung dalam dedaunan atau akar-akaran dikeluarkan menggunakan pelarut tertentu dalam alat khusus. Menyeduh kopi dengan air panas, merupakan ekstraksi kafein dari kopi agar larut dalam air. Kafein bersifat larut dalam air panas. Seperti halnya perubahan fisika, perubahan kimia pun banyak manfaatnya. Hampir semua industri yang memproduksi bahan baku menggunakan prinsip-prinsip perubahan kimia atau reaksi kimia. Dalam industri plastik, zat-zat organik yang bersumber dari gas alam dan minyak bumi diubah melalui
reaksi dan proses kimia menjadi plastik, misalnya polietilen (PE), polipropilen (PP), dan polivinilklorida (PVC). Hampir semua industri, mulai dari yang berteknologi sederhana (misalnya industri tahu) hingga yang berteknologi tinggi (misalnya pembuatan pesawat terbang) menerapkan prinsip-prinsip perubahan fisika dan perubahan kimia. Perubahan kimia dan perubahan fisika terkadang terjadi secara bersamaan, misalnya pada pembakaran lilin. Lilin terbakar menghasilkan nyala dan asap hitam (karbon). Hal ini menunjukkan terjadinya reaksi kimia. Di sisi lain, terjadi pula perubahan fisika yaitu lilin meleleh menjadi cair.
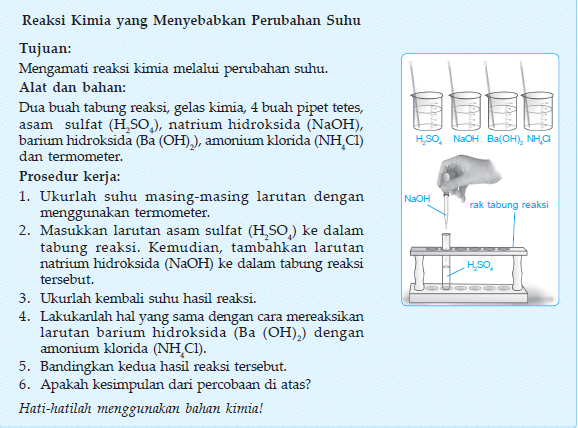
E. Reaksi Kimia
Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat yang baru dengan sifat-sifat yang baru. Reaksi kimia dituliskan dengan menggunakan lambang unsur. Marilah kita lihat bagaimana cara menyatakan suatu reaksi dengan menggunakan lambang. Perhatikan reaksi merkuri oksida yang menghasilkan merkuri dan oksigen berikut.
HgO → Hg + O2
Ahli kimia akan menerjemahkan lambang-lambang di atas sebagai berikut. “Molekul HgO yang terdiri dari satu atom merkuri (Hg) ditambah satu atom oksigen (O), menghasilkan (→) satu molekul yang terdiri dari satu atom merkuri (Hg) ditambah satu molekul yang terdiri dari dua atom oksigen (O2)”.Gabungan lambang yang menunjukkan suatu reaksi kimia dinamakan persamaan kimia. Zat yang bereaksi di sebelah kiri anak panah disebut pereaksi. Sedangkan zat di sebelah kanan anak panah disebut hasil reaksi. Jadi, HgO pada persamaan kimia di atas adalah pereaksi. Hg dan O2 adalah hasil reaksi. Hukum konservasi materi menyatakan bahwa dalam reaksi kimia biasa tidak ada materi yang hilang meskipun mungkin berubah. Jumlah atom dalam pereaksi harus tetap sama dengan yang dihasilkan, betapa pun atom-atom itu berubah untuk membentuk pola molekul yang baru. Apabila suatu persamaan memenuhi syarat-syarat itu, dapat dikatakan persamaan itu setimbang. Bagaimana dengan persamaan HgO → Hg + O2? Untuk mengimbangkan persamaan, kita tambahkan angka 2 sebelum HgO dan angka 2 lagi sebelum Hg. 2HgO berarti dua molekul yang masing-masing terdiri dari satu atom merkuri dan satu atom oksigen. Persamaan itu sekarang menjadi:2 HgO → 2 Hg + O2
Dengan kata lain, dua molekul merkuri oksida (HgO) yang masing-masing terdiri dari satu atom merkuri dan satu atom oksigen menghasilkan dua molekul merkuri yang masingmasing terdiri dari satu atom merkuri ditambah satu molekul oksigen, yang terdiri dari dua atom oksigen. Persamaan ini sekarang telah setimbang, di sebelah kiri ada dua atom merkuri dan dua atom oksigen, demikian juga di sebelah kanan. Perhatikan bahwa dalam hasil reaksi ditulis 2 Hg, bukan Hg2. Hal ini karena molekul merkuri hanya terdiri dari satu atom merkuri. Kalau angka 2 kita tuliskan di bawah, berarti kita mengatakan bahwa molekul itu mengandung dua atom dan ini keliru. Ingat bahwa dalam menyeimbangkan persamaan kita tidak boleh mengganti molekul. Kita hanya boleh mengubah jumlah molekul.
1. Ciri-Ciri Reaksi Kimia
Ketika terjadi reaksi kimia, terdapat perubahan-perubahan yang dapat kita amati. Perhatikan ciri-ciri reaksi kimia berikut.
a. Reaksi Kimia dapat Menimbulkan Perubahan Warna
Lakukanlah kegiatan berikut untuk menyelidiki perubahan warna akibat reaksi kimia.
Dari Kegiatan di atas kamu dapat mengamati bahwa warna ungu pada larutan kalium permanganat (KMnO4) akan berubah jika direaksikan dengan larutan asam oksalat (H2C2O4). Perubahan kimia ini terjadi karena senyawa kalium permanganat berubah menjadi senyawa mangan sulfat (MnSO4) yang tidak berwarna. Demikian juga dengan tembaga karbonat (CuCO3) yang berwarna hijau akan berubah menjadi tembaga oksida (Cu2O) yang berwarna kehitaman dan karbon dioksida (CO2) setelah dipanaskan.
b. Reaksi Kimia dapat Membentuk Endapan
Lakukanlah kegiatan berikut untuk mengamati reaksi kimia yang menghasilkan endapan.
Lakukanlah kegiatan berikut untuk mengamati reaksi kimia yang menghasilkan endapan.
Dari Kegiatan di atas kamu dapat mengamati bahwa ketika barium klorida (BaCl2) direaksikan dengan natrium sulfat (Na2SO4) akan menghasilkan suatu endapan putih barium sulfat (BaSO4). Endapan putih yang terbentuk ini sukar larut dalam air. Reaksi kimia tersebut dapat dituliskan sebagai berikut.
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
(larutan) (larutan) (padatan) (larutan)
Banyak sekali zat-zat kimia yang direaksikan menimbulkan endapan. Contoh lain adalah larutan perak nitrat (AgNO3) direaksikan dengan larutan natrium klorida (NaCl) menghasilkan endapan putih perak klorida (AgCl) dan larutan natrium nitrat (NaNO3).
AgNO3 + NaCl → AgCl↓ + NaNO3
(larutan) (larutan) (padatan) (larutan)
 Sebenarnya apakah endapan itu? Endapan adalah zat yang memisahkan diri sebagai fase padat dari larutan. Endapan dapat berupa kristal (kristalin) atau koloid dan dapat dikeluarkan dari larutan dengan penyaringan atau sentrifugasi. Endapan terbentuk jika larutan menjadi terlalu jenuh dengan zat terlarut. Kelarutan suatu endapan sama dengan konsentrasi molar dari larutan jenuhnya. Kelarutan endapan bertambah besar dengan kenaikan suhu, meskipun dalam beberapa hal khusus (seperti kalium sulfat), terjadi sebaliknya. Laju kenaikan kelarutan dengan suhu berbeda-beda. Pada beberapa hal, perubahan kelarutan dengan berubahnya suhu dapat menjadi alasan pemisahan. Misal pemisahan ion timbal dari perak dan merkurium (I) dapat dicapai dengan mengendapkan ketiga ion itu mulamula sebagai klorida, diteruskan dengan menambahkan air panas pada campuran. Air panas akan melarutkan timbal klorida (PbCl2) tetapi perak dan raksa (I) klorida (HgCl) tidak larut di dalamnya. Setelah menyaring larutan panas tersebut, ion timbal akan ditemukan dalam filtrat.
Sebenarnya apakah endapan itu? Endapan adalah zat yang memisahkan diri sebagai fase padat dari larutan. Endapan dapat berupa kristal (kristalin) atau koloid dan dapat dikeluarkan dari larutan dengan penyaringan atau sentrifugasi. Endapan terbentuk jika larutan menjadi terlalu jenuh dengan zat terlarut. Kelarutan suatu endapan sama dengan konsentrasi molar dari larutan jenuhnya. Kelarutan endapan bertambah besar dengan kenaikan suhu, meskipun dalam beberapa hal khusus (seperti kalium sulfat), terjadi sebaliknya. Laju kenaikan kelarutan dengan suhu berbeda-beda. Pada beberapa hal, perubahan kelarutan dengan berubahnya suhu dapat menjadi alasan pemisahan. Misal pemisahan ion timbal dari perak dan merkurium (I) dapat dicapai dengan mengendapkan ketiga ion itu mulamula sebagai klorida, diteruskan dengan menambahkan air panas pada campuran. Air panas akan melarutkan timbal klorida (PbCl2) tetapi perak dan raksa (I) klorida (HgCl) tidak larut di dalamnya. Setelah menyaring larutan panas tersebut, ion timbal akan ditemukan dalam filtrat. c. Reaksi Kimia dapat Menimbulkan Perubahan Suhu
Lakukanlah kegiatan berikut agar kamu lebih memahamibahwa reaksi kimia dapat menimbulkan perubahan
Lakukanlah kegiatan berikut agar kamu lebih memahamibahwa reaksi kimia dapat menimbulkan perubahan
Dari Kegiatan 4.8 kamu dapat membuktikan bahwa reaksi kimia dapat menyebabkan perubahan suhu. Pada percobaan yang pertama ketika kamu mereaksikan asam sulfat (H2SO4) dan natrium hidroksida (NaOH) terjadi kenaikan suhu. Nah, reaksi kimia yang menghasilkan kenaikan suhu dinamakan reaksi eksoterm. Dapatkah kamu menyebutkan contoh reaksi eksoterm lainnya? Reaksi eksoterm dapat kamu temukan pada pembakaran kertas dan pembakaran bensin pada kendaraan bermotor. Pada percobaan kedua, saat kamu mereaksikan campuran barium hidroksida (Ba(OH)2) dan amonium klorida (NH4Cl), larutan tersebut akan menyerap panas di sekitarnya sehingga terjadi penurunan suhu. Reaksi kimia yang menyerap panas di sekitarnya dinamakan reaksi endoterm. Contoh reaksi endoterm dalam kehidupan sehari-hari adalah fotosintesis dan memasak makanan. Cobalah kamu cari contoh reaksi endoterm lainnya. Diskusikanlah dengan teman sekelompokmu.
 |
| Gas dikeluarkan saat botol minuman berkarbonasi dibuka. |
d. Reaksi Kimia dapat Menimbulkan Gas
Pernahkah kamu melarutkan tablet vitamin berkalsium tinggi (tablet effervescent) ke dalam segelas air? Ketika kamu melarutkan tablet vitamin berkalsium tinggi ke dalam segelas air, kamu akan melihat gelembung-gelembung gas muncul dari dalam larutan. Hal ini membuktikan bahwa dalam peristiwa reaksi kimia dapat menimbulkan gas. Selain contoh di atas, kamu juga dapat mengamati reaksi kimia yang menghasilkan gas pada saat kamu membuka kaleng minuman berkarbonasi. Nah, agar kamu lebih memahami bagaimana reaksi kimia dapat menghasilkan gas, lakukanlah kegiatan berikut.
Pernahkah kamu melarutkan tablet vitamin berkalsium tinggi (tablet effervescent) ke dalam segelas air? Ketika kamu melarutkan tablet vitamin berkalsium tinggi ke dalam segelas air, kamu akan melihat gelembung-gelembung gas muncul dari dalam larutan. Hal ini membuktikan bahwa dalam peristiwa reaksi kimia dapat menimbulkan gas. Selain contoh di atas, kamu juga dapat mengamati reaksi kimia yang menghasilkan gas pada saat kamu membuka kaleng minuman berkarbonasi. Nah, agar kamu lebih memahami bagaimana reaksi kimia dapat menghasilkan gas, lakukanlah kegiatan berikut.
Dari Kegiatan , kamu dapat mengamati bahwa reaksi kimia dapat menghasilkan produk yang berwujud gas.
Timbulnya gas dalam campuran ini dapat kamu amati karena gas muncul dalam bentuk gelembung-gelembung.
Contoh lain reaksi kimia yang dapat menimbulkan gas terjadi di tempat las karbid. Pernahkah kamu melihat proses penyambungan dua buah besi dengan cara dilas? Biasanya tukang las menggunakan panas untuk melelehkan besi yang akan disambung. Api yang digunakan oleh tukang las untuk memanaskan besi yang akan disambung biasanya diperoleh dari gas yang dihasilkan oleh reaksi antara karbid dengan air. Gas ini bersifat mudah terbakar (flammable).
karbid + air → gas (mudah terbakar)
Gas tersebut ditampung dalam tabung sehingga dapat digunakan untuk menghasilkan api dalam proses penyambungan logam besi. Sekarang, las karbid ini relatif lebih sedikit digunakan karena sudah tergantikan oleh las listrik. Gas apakah yang terbentuk dari reaksi kimia? Untuk menguji jenis gas yang terbentuk dalam reaksi kimia dapat dilakukan dengan beberapa cara, antara lain seperti berikut.
 |
| Antoine Laurent Lavoisier (26 Agustus 1743 - 8 Mei 1794) adalah seorang ahli kimia Prancis, yang meletakkan dasar-dasar kimia modern, termasuk cara penulisan persamaan reaksi kimia. Lihat Selengkapnya |
- Uji Karbon Dioksida
Uji karbon dioksida (CO2 ) dapat dilakukan dengan mengalirkan gas pada air kapur atau kalsium hidroksida (Ca(OH)2 ). Jika gas tersebut karbon dioksida (CO2 ) maka air kapur yang semula jernih menjadi keruh dan terbentuk endapan putih kalsium karbonat (CaCO3 ).
- Uji Oksigen
Uji oksigen dapat dilakukan dengan mendekatkan lidi yang membara di mulut tabung tempat reaksi. Bila bara makin besar berarti gas tersebut adalah gas oksigen, tetapi jika bara padam berarti gas yang dihasilkan adalah karbon dioksida.
- Uji Hidrogen
Uji hidrogen dilakukan dengan mendekatkan lidi yang menyala di dekat mulut tabung tempat reaksi. Jika terbentuk gas hidrogen maka akan terjadi letupanletupan kecil.
Tahukah kamu berapa lama suatu reaksi kimia dapat berlangsung? Berdasarkan laju reaksinya, maka reaksi kimia ada yang berlangsung cepat, dan ada pula yang berlangsung lambat. Contoh reaksi kimia yang berlangsung cepat adalah reaksi kimia pada tablet effervescent ketika dilarutkan dalam air, dan menyalakan kembang api. Adapun contoh reaksi kimia yang berlangsung lambat adalah proses korosi atau berkaratnya besi, reaksi pembuatan tempe dan tape. Bagaimana cara mengukur laju reaksi kimia? Laju reaksi kimia dapat ditentukan dengan mengukur berkurangnya jumlah reaktan yang bereaksi atau pertambahan jumlah produk yang terbentuk tiap satuan waktu tertentu. Laju reaksi kimia dipengaruhi oleh beberapa faktor. Dapatkah kamu menyebutkan faktor-faktor apa saja yang memengaruhi laju reaksi kimia? Faktor-faktor yang memengaruhi laju reaksi kimia di antaranya sebagai berikut. a. Pengaruh Ukuran Zat terhadap Laju Reaksi Menurutmu, manakah yang akan lebih cepat larut, satu bongkah garam atau satu sendok garam halus? Ketika kamu melarutkan satu bongkah garam dan satu sendok garam halus masing-masing ke dalam segelas air, maka garam halus akan lebih cepat larut dibandingkan garam bongkahan. Hal ini dikarenakan ukuran butiran garam halus lebih kecil dari ukuran bongkahan garam. Lakukanlah kegiatan berikut ini agar kamu lebih memahami bagaimana ukuran zat memengaruhi laju reaksi.
Dari Kegiatan kamu dapat mengamati bahwa kapur yang halus akan lebih cepat larut daripada kapur yang masih berbentuk bongkahan. Mengapa demikian? Ukuran materi zat yang bereaksi sangat memengaruhi luas
permukaan bidang sentuh antar reaktan. Oleh karena serbuk kapur ukurannya sangat kecil, serbuk kapur mempunyai luas bidang sentuh yang lebih luas dibandingkan batu kapur sehingga larutan asam sulfat akan lebih mudah bereaksi dengan serbuk kapur dibandingkan dengan kapur yang masih berbentuk bongkahan. Semakin luas permukaan suatu reaktan maka laju reaksinya semakin cepat. Reaktan yang berwujud cair dan gas sulit untuk diperluas bidang sentuhnya. Yang dapat dilakukan adalah memperbesar konsentrasinya. Contoh dalam kehidupan sehari-hari adalah proses pengunyahan makanan. Hal ini merupakan upaya memperluas permukaan sehingga memudahkan proses penguraian. Nah, dapatkah kamu memberikan contoh lain yang membuktikan bahwa ukuran zat berpengaruh terhadap kecepatan reaksi? Diskusikanlah dengan teman sekelompokmu, kemudian bacakan hasil diskusimu di depan kelas.
b. Pengaruh Suhu terhadap Laju Reaksi
Pemberian kalor atau pemanasan pada suatu reaksi kimia memengaruhi laju reaksi. Pada reaksi eksoterm bila suhu tinggi reaksi menjadi lambat, sedangkan pada reaksi endoterm, bila suhu tinggi reaksi menjadi cepat. Dalam reaksi endoterm, pada suhu tinggi, partikel-partikel zat akan bergerak lebih cepat daripada suhu rendah. Hal inilah yang menyebabkan reaksi kimia berjalan lebih cepat.Reaksi kimia terjadi ketika molekul-molekul dan atom-atom bertumbukan. Menaikkan suhu berarti menaikkan energikinetik partikel, sehingga partikel tersebut bergerak lebih cepat dan lebih sering bertumbukan. Inilah sebabnyamengapa laju reaksi pada reaksi endoterm lebih cepat padasuhu yang tinggi. Untuk memahami pengaruh suhu terhadap laju reaksi, lakukan Kegiatan berikut.
Apa yang terjadi jika buah-buahan dan sayuran dibiarkan di tempat terbuka? Buah dan sayuran segar jika dibiarkan di tempat terbuka lama kelamaan akan layu dan akhirnya membusuk. Untuk mengatasi masalah ini maka sayuran dan buah dimasukkan dalam lemari es. Suhu rendah dapat menghambat aktivitas mikroba penyebab busuk, sehingga laju reaksi pembusukan pada sayur dan buah dapat dihambat. Jadi dapat dikatakan suhu lebih tinggi mempercepat reaksi pembusukan pada buah dan sayuran.
c. Katalis
Beberapa reaksi berlangsung secara lambat meskipun suhu tinggi dan kontak antara zat yang bereaksi intensif. Dalam kasus seperti ini, zat lain yang tidak terlibat dalam reaksi dapat mempercepat perubahan kimia. Zat lain ini disebut katalis. Katalis umumnya zat padat, tetapi dapat juga berupa zat cair atau gas. Katalis mengubah laju reaksi, tetapi tidak memengaruhi hasil reaksi. Hal ini dapat dituliskan:
Beberapa reaksi berlangsung secara lambat meskipun suhu tinggi dan kontak antara zat yang bereaksi intensif. Dalam kasus seperti ini, zat lain yang tidak terlibat dalam reaksi dapat mempercepat perubahan kimia. Zat lain ini disebut katalis. Katalis umumnya zat padat, tetapi dapat juga berupa zat cair atau gas. Katalis mengubah laju reaksi, tetapi tidak memengaruhi hasil reaksi. Hal ini dapat dituliskan:
 |
| Logam nikel dalam bentuk serbuk digunakan sebagai katalis pembuatan sabun |
A + B + Z → AB + Z
Jika zat A direaksikan dengan zat B dengan katalis Z, maka pada akhir reaksi diperoleh produk reaksi AB dan katalis Z. Berbagai katalis dipergunakan untuk mengubah laju bermacam-macam reaksi. Sel-sel hidup mempunyai katalis reaksi yang disebut enzim yang memungkinkan terjadinya reaksi kimia di dalam sel. Enzim hanya dapat bekerja dengan baik pada keadaan tertentu misalnya suhu dan tingkat keasaman tertentu. Contoh enzim amilase yang berada dalam air ludah sebagai katalis dari pereaksi pati yang menghasilkan produk reaksi maltosa. Ahli kimia sering menggunakan katalis. Kadang-kadang, ditambahkannya sedikit saja katalis pada zat-zat yang bereaksi. Misalnya, menggabungkan serbuk nikel yang halus dengan minyak biji kapas agar minyak itu bereaksi dengan hidrogen untuk menghasilkan lemak padat yang dipergunakan sebagai bahan penyusut atau dipergunakan untuk pembuatan sabun. Campuran udara dan belerang dioksida yang melalui katalis serbuk platina akan bereaksi dengan cepat dan menghasilkan belerang trioksida (SO3).








0 comments:
Posting Komentar